 环保莞家
环保莞家  环保莞家
环保莞家 
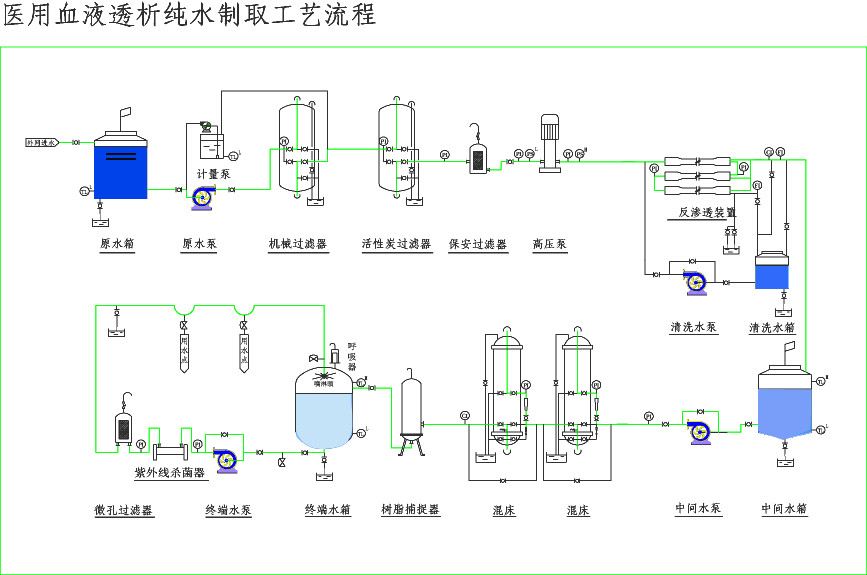
|
水质类别
|
用 途
|
水质要求
|
|
饮用水
|
1.制备纯化水的水源
|
应符合生活饮用水卫生标准(GB5749-85)
|
|
2.口服剂瓶子初洗
|
||
|
3.设备、容器的初洗
|
||
|
4.中药材、中药饮片的清洗、浸润和提取
|
||
|
纯化水
|
1.制备注射用水(纯蒸汽)的水源
|
应符合中国药典标准
|
|
2.非无菌药品直接接触药品的设备、器具和包装材料最后一次洗涤用水
|
||
|
3.注射剂、无菌药品瓶子的初洗
|
||
|
4.非无菌药品的配料
|
||
|
5.非无菌药品原料精制
|
||
|
注射用水
|
1.无菌产品直接接触药品的包装材料最后一次精洗用水
|
应符合中国药典标准
|
|
2.注射剂、无菌冲洗剂配料
|
||
|
3.无菌原料药精制
|
||
|
4.无菌原料药直接接触无菌原料的包装材料的最后洗涤用水
|
表2:纯化水水质标准:
|
项 目
|
中国药典(2000年版)
|
欧洲药典(2000年增补版)
|
美国药典(第24版)
|
|
来源
|
本品为蒸馏法、离子交换法、反渗透法或其他适宜方法制得
|
由符合法定标准的饮用水经蒸馏、离子交换或其他适宜方法制得
|
由符合美国环境保护协会或欧共体或日本法定要求的饮用水经适宜方法制得
|
|
性状
|
无色澄明液体,无臭、无味 无色澄明液体,无臭、无味
|
无色澄明液体,无臭、无味 无色澄明液体,无臭、无味
|
-
|
|
酸碱度pH
|
符合规定
|
-
|
-
|
|
氨
|
0.3μg/ml
|
-
|
-
|
|
氨化物、硫酸盐与钙盐、亚硝酸盐、二氧化碳、不挥发物
|
符合规定
|
-
|
-
|
|
硝酸盐
|
0.06μg/ml
|
0.2μg/ml
|
-
|
|
重金属
|
0.5μg/ml
|
0.1μg/ml
|
-
|
|
铝盐
|
-
|
生产渗析液时需控制此项目
|
-
|
|
易氧化物
|
符合规定
|
符合规定
|
-
|
|
总有机碳
|
-
|
0.5mg/L
|
0.5mg/ L
|
|
电导率
|
-
|
4.3μS/cm(20℃)
|
符合规定
|
|
细菌内毒素
|
-
|
0.25E.U./ml
|
-
|
|
无菌检查
|
-
|
-
|
符合规定(用于制备无菌制剂时控制)
|
|
微生物超标纠正标准
|
-
|
100个/ml
|
100个/ml
|
|
项 目
|
中国药典(2000年版)
|
欧洲药典(2000年增补版)
|
美国药典(第24版
|
|
来源
|
本品为纯化水经蒸馏所得的水
|
为符合法定标准的饮用水或纯化水经适当方法蒸馏而得
|
由符合美国环境保护协会或欧共体或日本法定要求的饮用水经蒸馏或反渗透纯化而得
|
|
性状
|
无色澄明,无臭、无味
|
无色澄明,无臭、无味
|
-
|
|
pH
|
5.0-7.0
|
-
|
-
|
|
氨
|
0.2μg/ml
|
-
|
-
|
|
氨化物、硫酸盐与钙盐、亚硝酸盐、二氧化碳、不挥发物
|
符合规定
|
-
|
-
|
|
硝酸盐
|
0.06μg/ml
|
0.2μg/ml
|
-
|
|
重金属
|
0.5μg/ml
|
0.1μg/ml
|
-
|
|
铝盐
|
-
|
用于生产渗透液时需控制此项目
|
-
|
|
易氧化物
|
符合规定
|
符合规定
|
-
|
|
总有机碳
|
-
|
0.5mg/L
|
0.5mg/L
|
|
电导率
|
-
|
1.1μS/cm(20℃)
|
符合规定
|
|
细菌内毒素
|
0.25E.U./ml
|
0.25E.U./ml
|
0.25E.U./ml
|
|
无菌检查
|
-
|
-
|
符合规定(用于制备无菌制剂时控制)
|
|
微生物超标纠正标准
|
-
|
10个/ml
|
10个/ml
|
